法律意见书
国家食品药品监督管理总局法制司
执法监督处(行政复议办公室):
依据《中华人民共和国行政复议法》,作为利害关系人柳海峰教授的委托律师,特对贵局作出的
第一、该行政行为在程序上违反《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品注册管理办法》。
《药品注册管理办法》第七条规定:“在药品注册过程中,药品监督管理部门认为涉及公共利益的重大许可事项,应当向社会公告,并举行听证。行政许可直接涉及申请人与他人之间重大利益关系的,药品监督管理部门在作出行政许可决定前,应当告知申请人、利害关系人享有要求听证、陈述和申辩的权利。”
本案
柳海峰教授在2005年该制备方法专利申报保护又增加了配方、检验标准、临床适应症的保护项目,所有的试验研究报告、和AB方全部进行了专利申报,在专利申请文件中,再次强调三花接骨散,国家给予了专利保护,该保护期延续20年。有效期到2025年。
由此可见,是
贵局的行政行为客观上侵害了
第二、该行政行为在实体上违反《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品注册管理办法》。
1、 《药品注册管理办法》第八条规定:“ 药品监督管理部门应当在行政机关网站或者注册申请受理场所公开下列信息:(一)药品注册申请事项、程序、收费标准和依据、时限,需要提交的全部材料目录和申请书示范文本;(二)药品注册受理、检查、检验、审评、审批各环节人员名单和相关信息;(三)已批准的药品目录等综合信息。”
目前,贵局网站搜索到三花接骨散的信息如下:
|
批准文号 |
国药准字Z10950013 |
|
产品名称 |
三花接骨散 |
|
英文名称 |
|
|
商品名 |
|
|
剂型 |
散剂(口服) |
|
规格 |
每袋装 |
|
生产单位 |
|
|
生产地址 |
辽宁省营口市站前区长征路南平里2号 |
|
产品类别 |
中药 |
|
原批准文号 |
|
|
批准日期 |
|
|
药品本位码 |
86901354000091 |
|
药品本位码备注 |
|
|
相关数据库查询 |
|
|
|
|
|
注 |
说明 : |
因此,请贵局严格按照贵局制定的《药品注册管理办法》,公开国药准字Z10950013三花接骨散的下列信息:(一)药品注册申请事项、程序、收费标准和依据、时限,需要提交的全部材料目录和申请书示范文本;(二)药品注册受理、检查、检验、审评、审批各环节人员名单和相关信息;(三)已批准的药品目录等综合信息。”
2、《药品注册管理办法》第十一条规定:“药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。”
请贵局澄清国药准字Z10950013三花接骨散是按照哪个类别获得国药准字Z10950013?
(1) 作为新药申请
《药品注册管理办法》第十二条规定:“新药申请,是指未曾在中国境内上
市销售的药品的注册申请。”
显然不是作为新药申请。
(2) 作为仿制药申请
《药品注册管理办法》第十二条规定:“仿制药申请,是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请;”
显然,明显侵犯了
而且,贵局批准的营口三花制药有限公司国药准字Z10950013三花接骨散与
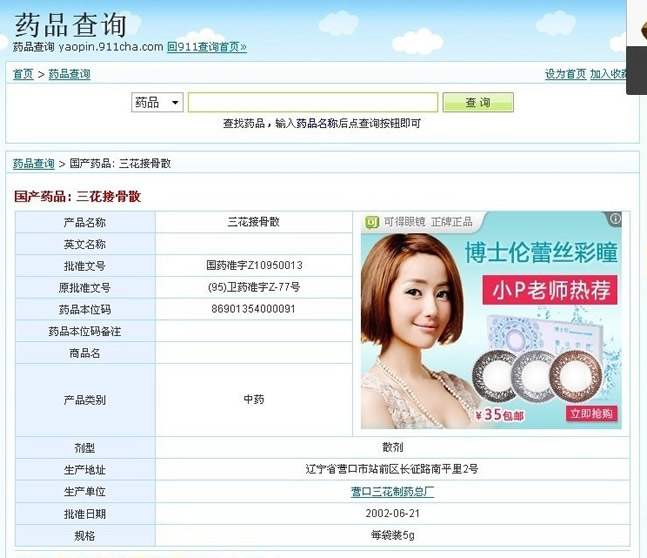
现在的批准文号国药准字Z10950013 ,产品名称三花接骨散,商品名
,剂型散剂(口服) ,规格每袋装
《药品生产质量管理规范实施指南》第
1、批号以6位数字表示,前两位数表示年份,中间两位数表示月份,最后两位数表示日期。如批号“990920",即
2、批号以6位数字表示,前两位数表示年份,中间两位数表示月份,后两位表示生产流水号。如“
3、批号以8位数字表示,即表示日号的6位数—2位数分好组成。分号表示的意义只有生产者知道,它可能表示同一日生产批号,如“991108
按照国家药品管理规定,若药品生产企业注销、吊销、停产,其药品生产许可证要同时被注销。如果再有新药厂生产,需重新申请药品生产许可证,方法有二:一是重新恢复生产,二是技术转移。因三花总厂主体已经不存在了,所以重新恢复生产的说法难以成行;而技术转移则是由原告发明人和知识产权拥有者授权给一家新的药厂生产,同时需有原三花总厂认可同意。显然,营口三花制药有限公司如今重新生产三花接骨散的方式,不属于上述任何一种。
营口三花制药有限公司尚没有拿到GMP认证,而国药准字号、GMP认证、药品生产许可证是任何一家药企进行生产销售的先决条件,缺一不可;据营口市工商行政管理局核实,被告同三花总厂的确没有任何关系,这意味着其存在虚假宣传嫌疑。
(3) 作为补充申请
《药品注册管理办法》第十二条规定:补充申请是指新药申请、仿制药申请或者进口药品申请经批准后,改变、增加或者取消原批准事项或者内容的注册申请。
营口三花制药有限公司三花接骨散【成分】三七、西红花、马钱子、血蝎、自然铜、沉香等十八味中药。【功能主治】化血化瘀,消肿止痛,接骨续筋。用于骨折筋伤,淤血肿痛等。
与柳海峰教授研制的三花接骨散成分功能主治完全一样。
显然,营口三花制药有限公司不属于补充申请。
(4) 作为再注册申请,
《药品注册管理办法》第十二条规定:“再注册申请是指药品批准证明文件有效期满后申请人拟继续生产或者进口该药品的注册申请。”
第一百二十条规定:“国家食品药品监督管理局核发的药品批准文号、《进口药品注册证》或者《医药产品注册证》的有效期为5年。有效期届满,需要继续生产或者进口的,申请人应当在有效期届满前6个月申请再注册。”
第一百二十二条规定:“药品再注册申请由药品批准文号的持有者向省、自治区、直辖市药品监督管理部门提出,按照规定填写《药品再注册申请表》,并提供有关申报资料。”
营口三花制药总厂国药准字Z10950013三花接骨散于
《药品注册管理办法》第一百二十六条规定:“有下列情形之一的药品不予再注册:(一)有效期届满前未提出再注册申请的;”
作为申请人的企业主体营口三花制药总厂已经破产,何来再注册申请人?
《药品注册管理办法》第一百二十七条规定:“对不予再注册的品种,除因法定事由被撤销药品批准证明文件的外,在有效期届满时,注销其药品批准文号、《进口药品注册证》或者《医药产品注册证》。”
由此可见,贵局批准营口三花制药有限公司国药准字Z10950013三花接骨散明显违法,希望依法予以更正,予以撤销。
第三、需要强调的是贵局否定了
1、2004年,柳海峰教授向国家药监局确认了原三花接骨散被注销之后,2005年与上海医药集团信谊制药、延安药业进行合作,向国家食品药品监督管理局申请恢复生产“三花接骨散”,历经6年、屡次申报,均没有通过审批。
在国家食品药品监督管理局下发的批号分别为
2009年的《国家食品药品监督管理局审批意见通知件》显示,因“处方中含有大毒药材马钱子粉,但未提供任何安全性研究资料”及“本品含有矿物药自然铜,未进行重金属考察”被驳回申请。2012年8月月22日,营口三花制药有限公司却凭同一张处方通过了批复。
2、
当
同时,
营口三花制药有限公司是个民营企业,并不是
“三花接骨散”是
更让
3、柳海峰教授于2012年11日,北上投诉,先后向中纪委、信访办、药监局、监察部等多个政府部门举报。
国家药监局信访办03号办案人员接受了报案。
可是,到
《中华人民共和国行政复议法》第十七条规定:“行政复议机关收到行政复议申请后,应当在五日内进行审查,对不符合本法规定的行政复议申请,决定不予受理,并书面告知申请人;对符合本法规定,但是不属于本机关受理的行政复议申请,应当告知申请人向有关行政复议机关提出。”
第三十一条规定:“ 行政复议机关应当自受理申请之日起六十日内作出行政复议决定;但是法律规定的行政复议期限少于六十日的除外。情况复杂,不能在规定期限内作出行政复议决定的,经行政复议机关的负责人批准,可以适当延长,并告知申请人和被申请人;但是延长期限最多不超过三十日。”
此致
北京市君益诚律师事务所
杨正律师

法律意见书文档下载
相关文章
- [2275]·三花接骨散 世纪总决战!(第三篇)
- [2886]·三花接骨散 世纪总决战!((第二篇)
- [3672]·三花接骨散 世纪总决战!(第一篇)
- [3060]·三花接骨散 世纪总决战!(连载)
- [2373]·假冒三花接骨散补充法律意见书
- [3194]·假冒三花接骨散法律意见书
热门文章
- [11104]· 中华骨伤医学会第三届理事会及二十一世纪中..
- [6624]· 柳海峰教授寻找爱护国宝的合伙人
- [6318]· 柳海峰先生近况采访
- [6212]· 柳海峰教授北京之行图片报道
- [5695]· 声明:目前幸酒遭到湖北福寿康宁侵权违法销..
- [5555]· 谈家桢院士赠书勉励并亲自题字“海峰大医师..
- [5551]· 柳海峰教授湖北行严厉打击侵权犯罪行为
- [5407]· 高占祥部长为“三花”题字
- [4917]· 新加坡、马来西亚将大量进口骨伤新药“三花..
- [4881]· 柳欧基恩官方淘宝店正式开通了!
|

